Pada kesempatan kali ini, Asymmetrical Life akan melanjutkan tulisan sebelumnya mengenai pemisahan kation golongan I.
Yup, sekarang kita akan membahas pemisahan kation golongan II ya.
Yup, sekarang kita akan membahas pemisahan kation golongan II ya.
Bagaimana? Sudah siap? Yuk kita telaah satu per satu pemisahan kation golongan II
Pendahuluan Kation Golongan II
Kation golongan II dikenal juga sebagai kation golongan H2S karena semua anggotanya mengendap dengan pengaliran gas H2S.
Golongan II termasuk golongan yang memiliki anggota kation yang paling banyak diantara semua golongan.
Maklum saja, kation-kation yang termasuk ke dalam golongan II antara lain Hg2+, Pb2+, Bi3+, Cu2+, Cd2+, As3+, As5+, Sb3+, Sb5+, Sn2+, dan Sn4+. Yup, jumlahnya mencapai 11 kation lho! Banyak sekali kan?
Mengapa kation Pb2+ masuk ke dalam golongan I dan golongan II?
Hal ini disebabkan karena endapan PbCl2 pada pemisahan kation golongan I memiliki kelarutan yang relatif tinggi sehingga ion Pb2+ masih dapat ditemukan pada larutan golongan II.
Saking banyaknya, kation golongan II juga dibagi lagi menjadi 2 sub-golongan, yaitu:
- Sub-golongan II A yaitu golongan Tembaga yang terdiri dari Hg2+, Pb2+, Bi3+, Cu2+, dan Cd2+.
- Sub-golongan II B yaitu golongan Arsen yang terdiri dari As3+, As5+, Sb3+, Sb5+, Sn2+, dan Sn4+.
Reaksi Yang Terjadi
Reaksi Kation Merkuri (II)
Hg2+ + 2HCl --> HgCl2 + 2H+
HgCl2 + H2S --> HgS (hitam) +2HCl
3HgS + 6HCl p + 2HNO3 p --> 3HgCl2 + 3S + 2NO + 4H2O
2HgCl2 + SnCl2 --> Hg2Cl2 (putih) + SnCl4
Hg2Cl2 + SnCl2 --> 2Hg (hitam) + SnCl4
Reaksi Kation Timbal (II)
Pb2+ + 2HCl --> PbCl2 + 2H+
PbCl2 + H2S --> PbS (hitam) + 2HCl
3PbS + 8HNO3 encer --> 3Pb(NO3)2 + 3S + 2NO + 4H2O
Pb(NO3)2 + H2SO4 --> PbSO4 (putih) + 2HNO3
PbSO4 + 4CH3COONH4 --> (NH4)2[Pb(CH3COO)4] + (NH4)2SO4
(NH4)2[Pb(CH3COO)4] + K2CrO4 --> PbCrO4 (kuning) + 2CH3COOK + 2CH3COONH4
Reaksi Kation Bismuth (III)
Bi3+ + 3HCl --> BiCl3 + 3H+
2BiCl3 + 3H2S --> Bi2S3 (hitam) + 6HCl
Bi2S3 + 8HNO3 encer --> 2Bi(NO3)3 + 3S + 2NO + 4H2O
2Bi(NO3)3 + 3H2SO4 --> Bi2(SO4)3 + 6HNO3
Bi2(SO4)3 + 6NH4OH berlebih --> 2Bi(OH)3 putih+ 6(NH4)2SO4
2Bi(OH)3 + 3Na2[Sn(OH)4] --> 2Bi (hitam) + 3Na2[Sn(OH)6]
Reaksi Kation Tembaga (II)
Cu2+ + 2HCl --> CuCl2 + 2H+
CuCl2 + H2S --> CuS (hitam) + 2HCl
3CuS + 8HNO3 encer --> 3Cu(NO3)2 + 3S + 2NO + 4H2O
Cu(NO3)2 + H2SO4 --> CuSO4 + 2HNO3
CuSO4 + 4NH4OH berlebih --> [Cu(NH3)4]SO4 + 4H2O
[Cu(NH3)4]SO4 + 4CH3COOH --> CuSO4 + 4CH3COONH4
2CuSO4 + K4[Fe(CN)6] --> Cu2[Fe(CN)6] (merah coklat) + 2K2SO4
Reaksi Kation Kadmium (II)
Cd2+ + 2HCl --> CdCl2 + 2H+
CdCl2 + H2S --> CdS (kuning) + 2HCl
3CdS + 8HNO3 encer --> 3Cd(NO3)2 + 3S + 2NO + 4H2O
Cd(NO3)2 + H2SO4 --> CdSO4 + 2HNO3
CdSO4 + 4NH4OH berlebih --> [Cd(NH3)4]SO4 + 4H2O
[Cd(NH3)4]SO4 + 4KCN berlebih --> K2[Cd(CN)4] + K2SO4 + 4NH3
K2[Cd(CN)4] + H2S --> CdS (kuning) + 2HCN + 2KCN
Reaksi Kation Arsen (III)
As3+ + 3HCl --> AsCl3 + 3H+
2AsCl3 + 3H2S --> As2S3 (kuning) + 6HCl
As2S3 + 6(NH4)2S2 --> 2(NH4)3AsS3 + 3(NH4)2S3
2(NH4)3AsS3 + 6CH3COOH --> As2S3 (kuning) + 3H2S + 6CH3COONH4
As2S3 + 6NH4OH --> (NH4)3AsO3 + (NH4)3AsS3 + 3H2O
(NH4)3AsO3 + H2O2 --> (NH4)3AsO4 + H2O
(NH4)3AsO4 + MgCl2 --> NH4MgAsO4 putih + 2NH4Cl
Reaksi Kation Antimon (III)
Sb3+ + 3HCl --> SbCl3 + 3H+
2SbCl3 + 3H2S --> Sb2S3 (merah jingga) + 6HCl
Sb2S3 + 6(NH4)2S2 --> 2(NH4)3SbS3 + 3(NH4)2S3
2(NH4)3SbS3 + 6CH3COOH --> Sb2S3 (merah jingga) + 3H2S + 6CH3COONH4
Sb2S3 + HCl pekat --> 2SbCl3 + 3H2S
2SbCl3 + 3H2S --> Sb2S3 (sindur) + 6HCl
Reaksi Kation Timah (IV)
Sn4+ + 4HCl --> SnCl4 + 4H+
SnCl4 + 2H2S --> SnS2 (kuning) + 4HCl
SnS2 + 2(NH4)2S2 --> (NH4)2SnS3 + (NH4)2S3
(NH4)2SnS3 + 2CH3COOH --> SnS2 (kuning) + H2S + 2CH3COONH4
SnS2 + 4HCl pekat --> SnCl4 + 2H2S
3SnCl4 + 2Al --> 3SnCl2 + 2AlCl3
SnCl2 + HgCl2 --> SnCl4 + Hg (hitam)
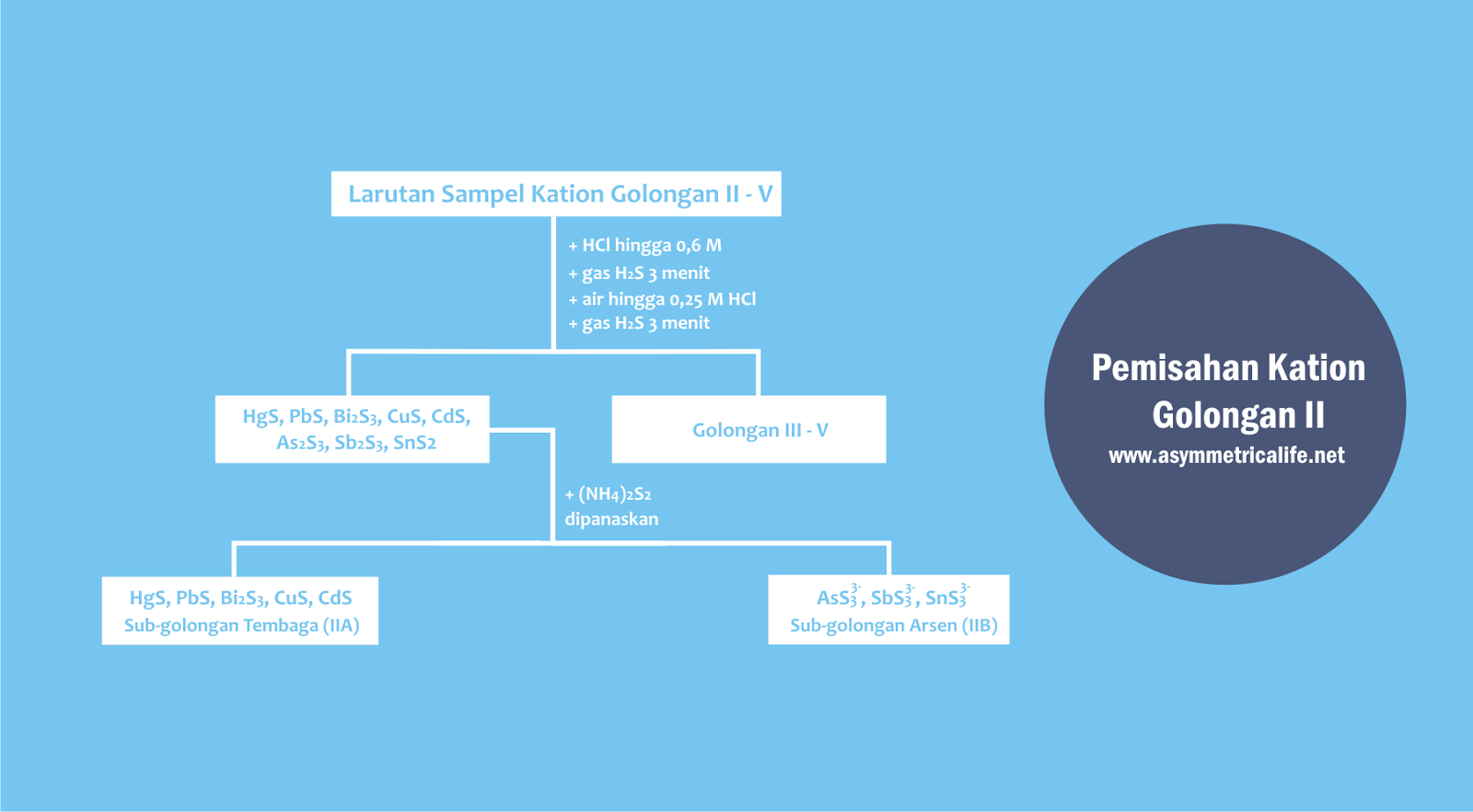
Prosedur Identifikasi dan Pemisahan Kation Golongan II
Prosedur Identifikasi dan Pemisahan Kation Golongan II
Perlu diketahui bahwa sampel yang digunakan untuk identifikasi golongan II berasal dari tahapan sebelumnya yaitu golongan I.
Pertama, siapkan larutan sampel yang berasal dari hasil pemisahan kation golongan I.
Ini merupakan syarat yang wajib dipenuhi karena kation golongan I yaitu Ag+, Hg+, dan Pb2+ mampu bereaksi dengan H2S sehingga ikut mengendap.
Kedua, pH diatur menjadi asam dengan penambahan HCl 0,6 M. Hal ini dilakukan untuk mengubah sub-golongan arsen yang berbentuk anionik menjadi kationik.
Catatan: sub-golongan arsen (As3+, Sb3+, dan Sn4+) dapat bersifat sebagai amfoter sehingga dapat bertindak sebagai kationik (contohnya As3+) maupun anionik (contohnya AsO33-).
Ketiga, larutan yang sudah diasamkan lalu dialiri gas H2S selama 3 menit. Apabila tidak ada gas H2S, bisa diganti dengan larutan H2S jenuh berlebih.
Proses ini dilakukan untuk memisahkan kation golongan II dari kation golongan III, IV, dan V. Kation golongan II akan mengendap sebagai sulfidanya, sedangkan golongan III sampai V tidak mengendap.
Keempat, larutan diencerkan dengan air hingga konsentrasi HCl menjadi 0,25 M kemudian dialiri gas H2S kembali selama 3 menit.
Hal ini bertujuan untuk menyempurnakan pengendapan kation golongan II sehingga tidak ada lagi kation yang belum mengendap.
Setelah tahap ini dilakukan, maka kation golongan II sudah berhasil dipisahkan dari golongan yang lainnya dan mengendap:
- Hg2+ mengendap sebagai HgS hitam
- Pb2+ mengendap sebagai PbS hitam
- Bi3+ mengendap sebagai Bi2S3 hitam
- Cu2+ mengendap sebagai CuS hitam
- Cd2+ mengendap sebagai CdS kuning
- As3+ mengendap sebagai As2S3 kuning
- Sb3+ mengendap sebagai Sb2S3 merah jingga
- Sn4+ mengendap sebagai SnS2 kuning
Kelima, ditambahkan Ammonium Polisulfida (NH4)2S2 dan dipanaskan pada suhu 50-600C. Tahap ini dilakukan untuk memisahkan antara sub-golongan tembaga dengan sub-golongan arsen.
Pada tahap ini:
- HgS tetap mengendap
- PbS tetap mengendap
- Bi2S3 tetap mengendap
- CuS tetap mengendap
- CdS tetap mengendap
- As2S3 larut menjadi AsS33-
- Sb2S3 larut menjadi SbS33-
- SnS2 larut menjadi SnS32-
Preparasi Pemisahan dan Identifikasi Sub-Golongan Tembaga
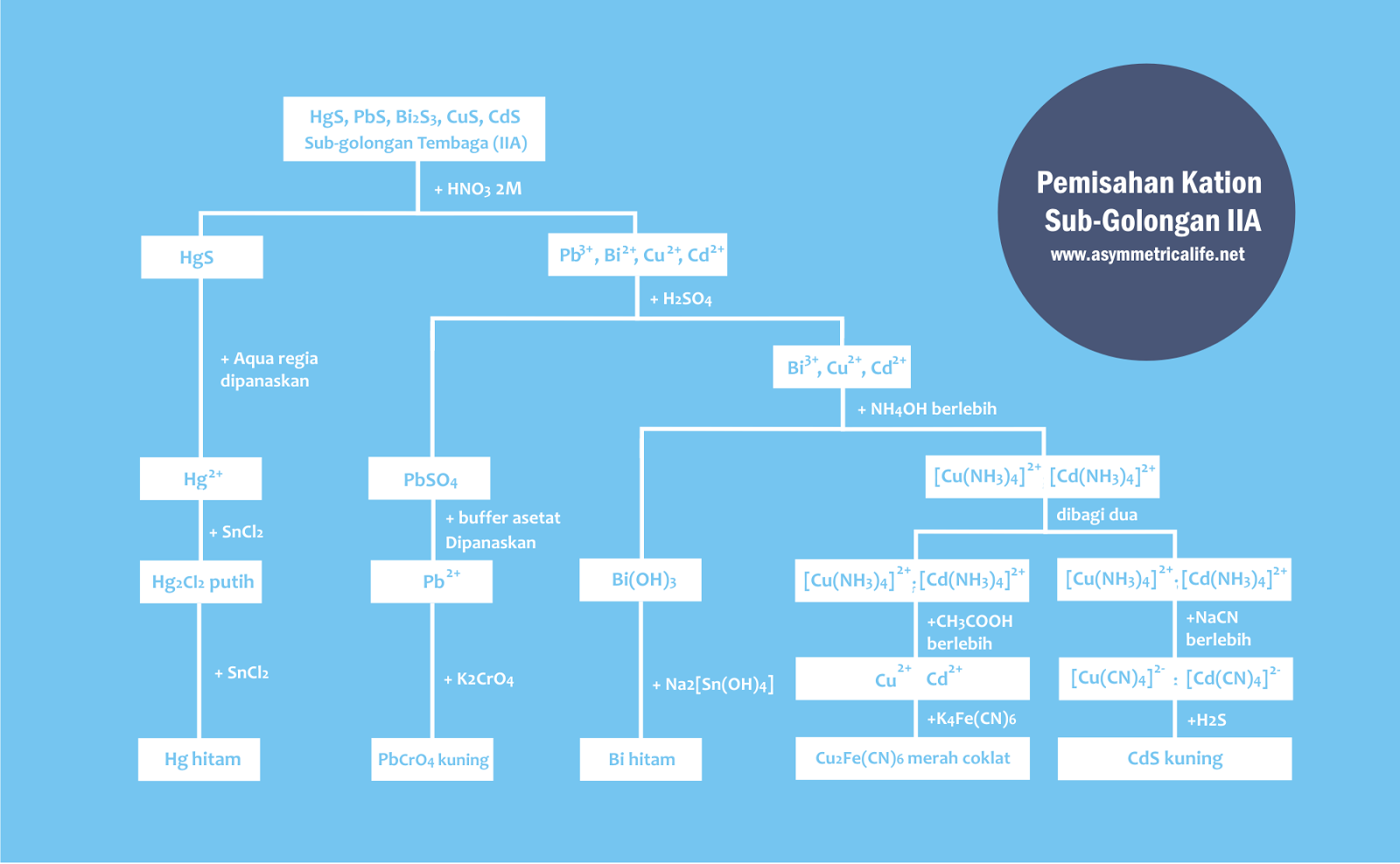
Pertama, endapan sub-golongan tembaga ditambahkan HNO3 2M lalu dipanaskan.
Asam Nitrat berfungsi untuk melarutkan endapan PbS, Bi2S3, CuS, dan CdS tetapi tidak melarutkan HgS.
Identifikasi Kation Merkuri (II)
Tahapan pertama yang harus dilakukan untuk mengidentifikasi Hg2+ adalah menambahkan Aqua Regia lalu dipanaskan untuk melarutkan endapan HgS.
Catatan: lakukan di ruang asam karena melibatkan raksa dan menghasilkan gas NO yang berbahaya bagi kesehatan.
Aqua regia adalah campuran 1 bagian HNO3 pekat dengan 3 bagian HCl pekat.
Kemudian ditambahkan SnCl2 sebagai reduktor kuat. Keberadaan Hg2+ dinyatakan positif apabila terbentuk endapan Hg2Cl2 berwarna putih.
Apabila penambahan SnCl2 berlebih, maka Hg2Cl2 akan tereduksi lebih lanjut hingga dihasilkan logam merkuri yang berwarna hitam.
Identifikasi Kation Timbal (II)
Pertama tambahkan H2SO4 encer pada larutan yang mengandung Pb2+, Bi3+, Cu2+, dan Cd2+. Kation Pb2+ akan mengendap sebagai PbSO4 sedangkan yang lainnya tidak mengendap.
Kemudian endapan PbSO4 dipisahkan dari larutan jernihnya. Setelah dipisahkan, tambahkan CH3COOH dan CH3COONH4 pada endapan PbSO4 sambil dipanaskan.
Endapan akan melarut kembali menjadi ion-ionnya.
Yang terakhir, larutan ditambahkan K2CrO4. Jika terbentuk endapan PbCrO4 yang berwarna kuning, maka Pb2+ dinyatakan positif.
Tambahkan larutan NH4OH berlebih ke dalam larutan yang mengandung Bi3+, Cu2+, dan Cd2+. Kation Bi3+ akan mengendap sebagai Bi(OH)3 sedangkan Cu2+ dan Cd2+ larut membentuk senyawa kompleks.
Identifikasi Kation Bismuth (III)
Tambahkan larutan NH4OH berlebih ke dalam larutan yang mengandung Bi3+, Cu2+, dan Cd2+. Kation Bi3+ akan mengendap sebagai Bi(OH)3 sedangkan Cu2+ dan Cd2+ larut membentuk senyawa kompleks.
Kemudian endapan dipisahkan dari larutan jernihnya (Cu2+ dan Cd2+)
Endapan Bi(OH)3 yang sudah dipisahkan ditambahkan reduktor kuat yaitu Na2[Sn(OH)4] yang dinamakan Natrium Tetrahidroksostanat(II).
Jika positif, maka Bi(OH)3 akan tereduksi menjadi logam Bi yang berwarna hitam.
Identifikasi Kation Tembaga (II) dan Kadmium (II)
Perlu ditekankan bahwa larutan yang mengandung Cu2+ dan Cd2+ harus dibagi 2 porsi, larutan 1 untuk identifikasi Cu2+ dan yang larutan 2 untuk Cd2+.
Untuk identifikasi Cu2+ pada larutan 1, perlu ditambahkan CH3COOH berlebih dan K4[Fe(CN)6].
Asam asetat berlebih berfungsi sebagai pengatur suasana asetikal sedangkan Kalium Heksasianoferat (II) berfungsi sebagai pengendap.
Jika terbemtuk endapan Cu2[Fe(CN)6] yang berwarna merah coklat, maka Cu2+ dinyatakan positif.
Sedangkan jika ingin mengidentifikasi Cd2+, pada larutan 2 ditambahkan KCN berlebih sebagai masking agent untuk kation Cu2+.
Kemudian ditambahkan H2S, jika terbentuk endapan CdS yang berwarna kuning maka Cd2+ dinyatakan positif.
Preparasi Pemisahan dan Identifikasi Sub-Golongan Arsen
Pada tahap sebelumnya, sub-golongan Arsen larut membentuk garam Tio akibat penambahan Ammonium Polisulfida.
Pada tahap preparasi ini, kation sub-golongan Arsen kembali diendapkan menjadi garam sulfidanya dengan penambahan Asam Asetat berlebih.
Kemudian endapan As2S3, Sb2S3, dan SnS2 ditambahkan HCl pekat sambil dihomogenkan. Proses ini dilakukan untuk melarutkan Sb2S3 dan SnS2 tetapi tidak melarutkan As2S3.
Endapan As2S3 dipisahkan dari larutan yang mengandung Sb3+ dan Sn4+ kemudian siap untuk diidentifikasi.
Endapan As2S3 yang sudah dipisahkan lalu ditambahkan NH4OH untuk mengubah As3+ kationik menjadi AsO33- anionik. Perlu diperhatikan bahwa proses ini tidak melibatkan redoks.
Identifikasi Kation Arsen (III)
Endapan As2S3 yang sudah dipisahkan lalu ditambahkan NH4OH untuk mengubah As3+ kationik menjadi AsO33- anionik. Perlu diperhatikan bahwa proses ini tidak melibatkan redoks.
Setelah itu, tambahkan H2O2 sebagai oksidator untuk mengoksidasi AsO33- menjadi AsO43-.
Tahap terakhir adalah penambahan campuran magnesia untuk mengendapkan AsO43- menjadi endapan NH4MgAsO4 yang berwarna putih. Jika terbentuk, maka As3+ dinyatakan positif.
Tahap terakhir adalah penambahan campuran magnesia untuk mengendapkan AsO43- menjadi endapan NH4MgAsO4 yang berwarna putih. Jika terbentuk, maka As3+ dinyatakan positif.
Catatan: campuran magnesia adalah larutan campuran yang dibuat dari MgCl2 · 6H2O sebanyak 80 gram, NH4Cl sebanyak 160 gram, dan NH4OH pekat sebanyak 320 ml.
Untuk mengidentifikasi Sb3+ dan Sn4+, larutan dibagi menjadi 2 bagian yaitu larutan 1 untuk identifikasi Sb3+ dan larutan 2 untuk identifikasi Sn4+.
Identifikasi Kation Antimon (III) dan Timah (IV)
Untuk mengidentifikasi Sb3+ dan Sn4+, larutan dibagi menjadi 2 bagian yaitu larutan 1 untuk identifikasi Sb3+ dan larutan 2 untuk identifikasi Sn4+.
Untuk identifikasi Sb3+, pada larutan 1 ditambahkan H2C2O4 kemudian dialiri gas H2S.
Penambahan Asam Oksalat berfungsi sebagai masking agent untuk kation Sn4+ sehingga tidak ikut bereaksi dengan H2S.
Jika Sb3+ positif, maka ditandai dengan terbentuknya endapan Sb2S3 yang berwarna merah jingga.
Sedangkan untuk identifikasi Sn4+, pada larutan 2 ditambahkan logam alumunium atau besi kemudian diikuti dengan penambahan HgCl2.
Logam alumunium atau besi akan mereduksi Sn4+ menjadi Sn2+. Sedangkan penambahan HgCl2 berfungsi sebagai oksidator bagi kation Sn2+ yang terbentuk.
Jika HgCl2 ditambahkan berlebih, maka akan terbentuk endapan Hg2Cl2 yang berwarna putih. Namun apabila HgCl2 ditambahkan sedikit, maka akan terbentuk endapan logam Hg yang berwarna hitam.
Bagan/Skema Identifikasi Kation Golongan II
Seperti pada bagian sebelumnya, saya akan memberikan prosedur kerja dalam bentuk bagan/skema agar lebih mudah dipahami.
Klik untuk zoom atau download :)

Penutup...
Itulah materi pemisahan kation golongan II, semoga bermanfaat,
Jika ada yang ingin ditanyakan, silakan tulis di kolom komentar ya :)


ditunggu share untuk golongan III,IV dan V
ReplyDeleteYa, secepatnya ya. Makasih sudah berkunjung :)
DeleteTerimakasih banyak bang 😂
ReplyDeletemantab om
ReplyDeletelanjutkan tuk gol III, IV, V