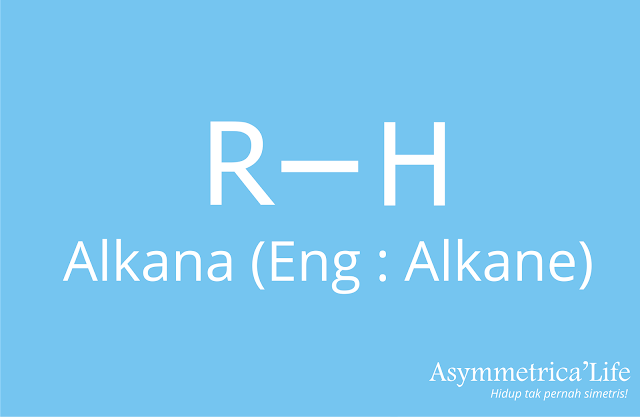
Definisi Alkana
Alkana adalah senyawa hidrokarbon dengan rantai terbuka dan siklis atau tertutup dengan jenis ikatan berupa ikatan tunggal (single bond atau ikatan jenuh).Beberapa ciri – ciri alkana:
- Ikatannya tunggal (jenuh / single bond),
- Memiliki rumus umum CnH2n+2,
- Nama lainnya paraffin (parrum = kecil, affinis = affinitas sehingga paraffin adalah senyawa kereaktifan yang kecil), dan
- Alkana yang paling sederhana adalah Metana (CH4).
Tata Nama Alkana
Aturan IUPAC
Penamaan senyawa menurut IUPAC
(International Union of Pure Applied Chemistry) merupakan penamaan yang
sistematik dan diterapkan di seluruh dunia.
Aturan dan kaidah penamaan Alkana menurut IUPAC adalah :
Aturan dan kaidah penamaan Alkana menurut IUPAC adalah :
- Identifikasi rantai karbon berkesinambungan terpanjang (sebagai rantai utama),
- Beri nomor dimulai dari ujung yang terdekat dengan cabang,
- Identifikasi jenis cabang dan beri nomor sesuai nomor pada rantai utama,
- Tuliskan nama IUPACnya sesuai format berikut : (nomor posisi cabang) – (nama cabang) – (nama rantai utama).
Beberapa poin-poin penting yang perlu diingat :
- Nama cabang disusun berdasarkan alfabet,
- Jika ada dua atau lebih cabang yang sama, gunakan prefix (di untuk 2, tri untuk 3, tetra untuk 4, d.l.l.)
- Prefix tidak disusun berdasarkan alphabet,
- Jika nomor dipisahkan dengan nomor, beri tanda koma.
- Jika nomor dipisahkan dengan huruf, beri tanda strip.
- Jika huruf dipisahkan dengan huruf, tidak diberi tanda apa–apa dan tidak diberi spasi.



TABEL RANTAI INDUK ALKANA (DERET HOMOLOG)
ΣC
|
NAMA IUPAC
|
Struktur
|
1
|
Methana
|
CH4
|
2
|
Ethana
|
CH3 – CH3
|
3
|
Propana
|
CH3 – CH2 – CH3
|
4
|
Butana
|
CH3 – CH2 – CH2 –
CH3
|
5
|
Pentana
|
CH3 – CH2 – CH2 –
CH2 – CH3
|
6
|
Heksana
|
CH3 – CH2 – CH2 –
CH2 – CH2 – CH3
|
7
|
Heptana
|
CH3 – CH2 – CH2 –
CH2 – CH2 – CH2 – CH3
|
8
|
Oktana
|
CH3 – CH2 – CH2 –
CH2 – CH2 – CH2 – CH2 – CH3
|
9
|
Nonana
|
CH3 – CH2 – CH2 –
CH2 – CH2 – CH2 – CH2 – CH2
– CH3
|
10
|
Dekana
|
CH3 – (CH2)8 – CH3
|
11
|
Undekana
|
CH3 – (CH2)9 – CH3
|
12
|
Dodekana
|
CH3 – (CH2)10 – CH3
|
13
|
Tridekana
|
CH3 – (CH2)11 – CH3
|
Aturan trivial / common
Aturan / kaidah penamaan alkana aturan
common adalah dengan menggunakan prefix, yaitu
n, iso, dan neo.
- n (normal) digunakan jika rantai karbonnya lurus tak bercabang,
- iso digunakan jika rantai karbon utamanya mengikat satu buah methyl pada bagian pangkalny, dan
- neo digunakan jika rantai karbon utamanya mengikat dua buah methyl pada bagian pangkalnya.
Isomer Alkana
Isomer adalah dua pasang senyawa atau lebih yang memiliki rumus
molekul yang sama tetapi berbeda rumus bangun atau strukturnya.
Alkana hanya memiliki satu jenis isomer yaitu isomer rantai (chain isomer).
Isomer rantai yaitu isomer yang memiliki rumus molekul yang sama tetapi berbeda di penyusunan atom karbon. Contohnya :
Alkana hanya memiliki satu jenis isomer yaitu isomer rantai (chain isomer).
Isomer rantai yaitu isomer yang memiliki rumus molekul yang sama tetapi berbeda di penyusunan atom karbon. Contohnya :
Sifat–Sifat Alkana
Sifat Fisika Alkana
Alkana memiliki lima jenis sifat fisika yang dapat dipelajari, antara lain:- Kepolaran
- Kelarutan
- Massa jenis
- Titik didih, dan
- Fase
Kepolaran Alkana
Sebelum kita mempelajari kepolaran pada molekul alkana, lebih baik kita mempelajari terlebih dahulu mengenai pengertian dari kepolaran itu sendiri.
Beberapa syarat molekul dikatakan polar :
Beberapa syarat molekul dikatakan polar :
- Memiliki satu atau lebih ikatan polar,
- Memiliki perbedaan elektronegativitas yang besar,
- Momen dipole ≠ 0,
- Memiliki pasangan electron bebas,
- Dapat membentuk ikatan Hidrogen, dan
- Merupakan molekul yang tidak simetris.
Karena alkana adalah senyawa yang terbentuk dari atom Karbon dan Hidrogen, maka alkana merupakan molekul yang bersifat non–polar.
Hal ini dikarenakan perbedaan elektronegativitas antara Karbon dan Hidrogen sangat kecil.
Kelarutan Dalam Pelarut Polar dan Non Polar
Untuk menentukan kelarutan suatu senyawa dalam pelarut, dapat digunakan prinsip like dissolve like.
Like dissolve like adalah suatu prinsip yang menyatakan bahwa senyawa polar akan larut dalam pelarut yang bersifat polar juga.
Begitu pula sebaliknya, senyawa yang bersifat non-polar akan larut dalam pelarut yang non-polar juga.
Karena alkana merupakan molekul yang bersifat non–polar, maka dengan mengaplikasikan prinsip like dissolve like dapat disimpulkan bahwa alkana hanya larut dalam pelarut non–polar seperti CCl4 dan tidak larut dalam pelarut polar seperti air.
Like dissolve like adalah suatu prinsip yang menyatakan bahwa senyawa polar akan larut dalam pelarut yang bersifat polar juga.
Begitu pula sebaliknya, senyawa yang bersifat non-polar akan larut dalam pelarut yang non-polar juga.
Karena alkana merupakan molekul yang bersifat non–polar, maka dengan mengaplikasikan prinsip like dissolve like dapat disimpulkan bahwa alkana hanya larut dalam pelarut non–polar seperti CCl4 dan tidak larut dalam pelarut polar seperti air.
Massa Jenis
Massa jenis adalah massa suatu zat per satuan volumenya.
Pada umumnya, senyawa alkana memiliki massa jenis ± 0,7 sampai 0,8 gram/ml. Karena massa jenisnya lebih kecil dari massa jenis air, maka alkana akan mengapung di atas air.
Pada umumnya, senyawa alkana memiliki massa jenis ± 0,7 sampai 0,8 gram/ml. Karena massa jenisnya lebih kecil dari massa jenis air, maka alkana akan mengapung di atas air.
Titik Didih
Secara umum, setiap kenaikan bobot molekul maka titik didih akan ikut naik.
Pada alkana, setiap penambahan satu atom karbon maka titik didih naik 300C. Contohnya Etana memiliki titik didih pada -60,50C dan propana (bertambah satu atom karbon) memiliki titik didih pada suhu -30,50C).
Selain itu, struktur rantai pada suatu senyawa juga mempengaruhi nilai titik didihnya.
Struktur rantai yang lurus akan menyebabkan luas permukaan suatu senyawa menjadi lebih besar dibandingkan dengan senyawa yang rantainya bercabang.
Luas permukaan yang besar akan membuat titik didihnya juga semakin besar. Begitu pula sebaliknya.
Alkana yang strukturnya lurus (luas permukaan semakin besar) akan memiliki titik didih yang lebih besar dibandingkan dengan alkana yang strukturnya bercabang (luas permukaan semakin kecil), dengan asumsi bahwa keduanya memiliki jumlah atom karbon yang sama.
Fasa Dalam Suhu Ruang
Dalam suhu ruang, Alkana dengan jumlah atom karbon 1 sampai
4 memiliki fasa berupa gas.
Sedangkan alkana dengan jumlah atom karbon sebanyak 5 sampai 17 memiliki fase berupa cairan.
Dan yang terakhir, alkana dengan jumlah atom karbon lebih dari 17 akan memiliki fase padat dalam suhu kamar.
Sedangkan alkana dengan jumlah atom karbon sebanyak 5 sampai 17 memiliki fase berupa cairan.
Dan yang terakhir, alkana dengan jumlah atom karbon lebih dari 17 akan memiliki fase padat dalam suhu kamar.
Sifat Kimia Alkana
Sifat kimia adalah sifat suatu zat yang berhubungan dengan reaksi kimia.
- Reaksi pembakaran
- Reaksi substitusi
- Reaksi nitrasi
- Reaksi sulfonasi
- Cracking / pyrolysis
- Isomerisasi
- Aromatisasi
Reaksi Pembakaran
Reaksi pembakaran adalah reaksi sebuah senyawa, umumnya senyawa organik,
dengan gas Oksigen dan kehadiran panas atau kalor.
Ada dua jenis reaksi pembakaran alkana, yaitu :
Ada dua jenis reaksi pembakaran alkana, yaitu :
Reaksi pembakaran sempurna, dengan syaratnya yaitu jumlah Oksigen cukup dan menghasilkan CO2 dan air. Contohnya adalah sebagai berikut:
CH4 + 2O2 --> CO2 + 2 H2O
Sedangkan reaksi pembakaran tidak sempurna, dengan syaratnya yaitu jumlah Oksigen tidak cukup dan menghasilkan CO atau CO2 atau C dan air. Contohnya adalah:
2 CH4 + 7/2 O2
--> CO2 + 4 H2O + CO
Reaksi Substitusi Halogen
Reaksi substitusi (penggantian) adalah reaksi kimia
dimana sebuah atom atau gugus fungsi pada sebuah molekul digantikan oleh atom atau gugus fungsi lainnya.
Subtitusi halogen dibagi menjadi empat, yaitu Fluorinasi, Klorinasi, Brominasi, dan Iodinasi.
Subtitusi halogen dibagi menjadi empat, yaitu Fluorinasi, Klorinasi, Brominasi, dan Iodinasi.
Fluorinasi
Alkana dapat disubstitusi dengan F2
sesuai persamaan berikut:
RH + F2 --> RF + HF
Perlu diketahui bahwa F2 merupakan zat yang bersifat explosive atau mudah meledak. Untuk mengurangi kereaktifannya, gas tersebut dapat diencerkan dengan gas yang bersifat inert, yaitu gas Nitrogen atau N2.
Klorinasi dan Brominasi
Prinsip dari klorinasi dan brominasi
alkana adalah pembentukan radikal bebas atau disebut juga homolisis.
Pada tahap ini jenis reaksi dibagi menjadi 4, yaitu:
Pada tahap ini jenis reaksi dibagi menjadi 4, yaitu:
- Monosubstitusi atau monoklorinasi atau monobrominasi : menggantikan satu atom Hidrogen pada alkana dengan satu atom Klor atau Brom.
- Disubstitusi atau diklorinasi atau dibrominasi yaitu menggantikan dua atom Hidrogen pada alkana dengan dua buah atom Klor atau Brom.
- Trisubstitusi atau triklorinasi atau tribrominasi adalah menggantikan tiga atom Hidrogen pada alkana disubstitusi dengan tiga buah atom Klor atau Brom.
- Tetrasubstitusi atau tetraklorinasi atau tetrabrominasi adalah menggantikan empat atom Hidrogen pada alkana dengan empat buah atom Klor atau Brom.
Untuk contohnya, silakan lihat pada gambar di bawah ini.

Iodinasi
Iodinasi sebuah molekul alkana akan menghasilkan
Alkil Iodida dan molekul Asam Iodida atau HI.
Perlu diketahui bahwa HI bersifat sebagai reduktor kuat sehingga akan mengakibatkan reaksi kesetimbangan atau reversible.
Karena sifat reaksinya yang reversible ini membuat produk tidak akan pernah dapat diambil. Oleh karena itu, HI yang terbentuk harus segera dihilangkan.
Untuk menghilangkan HI, dapat dipakai HIO3.
Perlu diketahui bahwa HI bersifat sebagai reduktor kuat sehingga akan mengakibatkan reaksi kesetimbangan atau reversible.
Karena sifat reaksinya yang reversible ini membuat produk tidak akan pernah dapat diambil. Oleh karena itu, HI yang terbentuk harus segera dihilangkan.
Untuk menghilangkan HI, dapat dipakai HIO3.
RH + I2 --> RI + HI (reaksinya
reversible)
5 HI + HIO3 --> 3 I2 + 3 H2O
Reaksi Nitrasi
Prinsip dasar reaksi nitrasi pada alkana adalah mekanisme
substitusi. Hal ini mirip seperti reaksi Halogenasi yang telah dibahas sebelumnya.
Alkana dapat bereaksi dengan HNO3 pada suhu 4500C untuk membentuk Nitroalkana.
Alkana dapat bereaksi dengan HNO3 pada suhu 4500C untuk membentuk Nitroalkana.
CH3 – H + HO –
NO2 --> H3C – NO2 (Nitromethane) + H2O
Reaksi Sulfonasi
Seperti nitrasi, sulfonasi alkana merupakan
reaksi subsitusi dimana Alkana bereaksi dengan H2SO4 pada
suhu 4500C membentuk Alkana sulphuric acid.
R – H
+ OH – SO3H --> R –
SO3H (alkane sulphuric acid) +
H2O
Cracking / Pyrolysis
Cracking dan pirolisis adalah salah satu cara untuk memotong-motong rantai suatu senyawa yang panjang menjadi senyawa dengan rantai yang lebih pendek.
Pada alkana, alkana berantai panjang dapat dipecah–pecah menjadi alkana berantai pendek dan alkena.
Ada dua jenis cracking / pyrolysis pada Alkana, yaitu :
Pada alkana, alkana berantai panjang dapat dipecah–pecah menjadi alkana berantai pendek dan alkena.
Ada dua jenis cracking / pyrolysis pada Alkana, yaitu :
- Thermal pyrolysis, dimana suhu dan tekanan yang digunakan sangat tinggi (450 – 7500C 70 atm),
- Catalyst pyrolysis, dimana suhu dan tekanan yang digunakan lebih rendah akan tetapi membutuhkan tambahan katalis berupa zeolite (SiO2, Al2O3).
Isomerisasi
Alkana berantai lurus dapat dikonversi
menjadi alkana berantai cabang (isomer rantai) dengan HCl dan katalis AlCl3
pada suhu 250C.


Aromatisasi
Alkana yang mengandung 6 sampai 10 atom karbon
dapat diubah menjadi senyawa aromatik berupa Benzena dan deret homolognya dengan katalis Cr2O3
dan Al2O3 pada suhu 6000C.
Selain Cr2O3 dan Al2O3, Pt juga dapat digunakan sebagai katalis.
Reaksi aromatisasi pada Alkana melibatkan siklisasi (pembentukan senyawa siklik) dan dehidrogenasi (pelepasan molekul Hidrogen).
Contoh reaksi aromatisasi pada alkana adalah:
Selain Cr2O3 dan Al2O3, Pt juga dapat digunakan sebagai katalis.
Reaksi aromatisasi pada Alkana melibatkan siklisasi (pembentukan senyawa siklik) dan dehidrogenasi (pelepasan molekul Hidrogen).
Contoh reaksi aromatisasi pada alkana adalah:

Pembuatan Alkana
Alkana adalah golongan senyawa yang sangat besar manfaatnya bagi manusia.
Tahu nggak bahwa ternyata bensin, gas LPG, lilin, dan berbagai macam pembungkus pada buah di supermarket adalah salah satu contoh aplikasi atau kegunaan dari Alkana.
Oleh karena itu, penting sekali untuk mempelajari tentang sintesis atau pembuatan Alkana
Alkana dapat dibuat dengan tujuh cara :
Tahu nggak bahwa ternyata bensin, gas LPG, lilin, dan berbagai macam pembungkus pada buah di supermarket adalah salah satu contoh aplikasi atau kegunaan dari Alkana.
Oleh karena itu, penting sekali untuk mempelajari tentang sintesis atau pembuatan Alkana
Alkana dapat dibuat dengan tujuh cara :
- Hidrogenasi alkena dan alkuna,
- Hidrolisis pereaksi Grignard (Grignard reagent),
- Reaksi Wurtz,
- Reduksi Alkilhalida,
- Sintesis Corey–House,
- Dekarboksilasi Asam Karboksilat, dan
- Elektrolisis Kolbe
Hidrogenasi Alkena dan Alkuna
Hidrogenasi adalah reaksi pemutusan
ikatan rangkap oleh Hidrogen atau H2. Reaksi pemutusan ikatan rangkap sering disebut juga sebagai reaksi adisi.
Reaksi Hidrogenasi membutuhkan katalis berupa logam Ni, Pt, atau Pd dengan suhu yang diatur pada angka 2500C.
Berikut adalah contoh reaksi Hidrogenasi Alkuna dengan katalis Nikel yang menghasilkan produk berupa Alkana.
Reaksi Hidrogenasi membutuhkan katalis berupa logam Ni, Pt, atau Pd dengan suhu yang diatur pada angka 2500C.
Berikut adalah contoh reaksi Hidrogenasi Alkuna dengan katalis Nikel yang menghasilkan produk berupa Alkana.

Hidrolisis Pereaksi Grignard (Grignard Reagent)
Pereaksi Grignard adalah senyawa
Alkil Magnesium Halida (RMgX), dimana X dapat berupa Klorida, Bromida, atau Iodida.
Oh iya, Pereaksi Grignard dapat diperoleh dengan mereaksikan Alkil Halida dengan Magnesium dalam Eter yang tidak mengandung air (anhydrous).
Oh iya, Pereaksi Grignard dapat diperoleh dengan mereaksikan Alkil Halida dengan Magnesium dalam Eter yang tidak mengandung air (anhydrous).
Reaksi Wurtz
Reaksi Wurtz adalah reaksi Alkil Halida dengan logam Natrium untuk menghasilkan alkana simetris yang
mengandung atom karbon yang genap.
Contoh pembuatan Alkana melalui reaksi Wurtz adalah sebagai berikut:
Contoh pembuatan Alkana melalui reaksi Wurtz adalah sebagai berikut:
Reduksi Alkil Halida
Reduksi Alkil Halida dengan reduktor berlangsung dalam suasana Asetikal (Asam Asetat) dengan katalis Zn atau paduan logam
Zn–Cu dan akan menghasilkan alkana dan Asam Halida.
Biasanya reduktor yang sering digunakan adalah Hidrogen.
Berikut adalah contoh reduksi Alkil Halida dengan reduktor berupa gas Hidrogen
Biasanya reduktor yang sering digunakan adalah Hidrogen.
Berikut adalah contoh reduksi Alkil Halida dengan reduktor berupa gas Hidrogen
Sintesis Corey–House
Sintesis Corey–House dapat digunakan
untuk menghasilkan alkana yang tidak simetris. Atau bisa disimpulkan adalah alkana yang mengandung jumlah atom karbon yang
ganjil.
Bisa dibilang bahwa sintesis Corey House pada alkana adalah kebalikan dari Reaksi Wurtz.
Tahapan reaksi pada sintesis Corey-House dibagi menjadi tiga tahap :
Bisa dibilang bahwa sintesis Corey House pada alkana adalah kebalikan dari Reaksi Wurtz.
Tahapan reaksi pada sintesis Corey-House dibagi menjadi tiga tahap :
Tahap 1 yaitu Alkil Halida direaksikan
dengan logam Li dalam eter yang tidak mengandung air menghasilkan Alkil Litium
Tahap 2 yaitu Alkil Litium yang terbentuk pada tahap 1 direaksikan
dengan Tembaga (I) Bromida menghasilkan Litium Dialkil Tembaga (I)
Tahap 3 adalah Lithium Dialkil Tembaga (I)
direaksikan dengan Alkil Halida Primer menghasilkan alkana.
Reaksi pada sintesis Corey-House dapat dilihat pada gambar berikut:
Reaksi pada sintesis Corey-House dapat dilihat pada gambar berikut:
Dekarboksilasi Asam Karboksilat
Dekarboksilasi adalah suatu jenis reaksi yang melepaskan gugus karboksilat pada suatu senyawa karboksilat.
Jika garam dari asam karboksilat yang dipanaskan dengan soda lime (NaOH + CaO), maka gugus karboksilat (COO-) akan lepas membentuk CO2 dan alkana pun dihasilkan.
Adapun reaksi yang terjadi pada dekarboksilasi Asam Karboksilat adalah:
Jika garam dari asam karboksilat yang dipanaskan dengan soda lime (NaOH + CaO), maka gugus karboksilat (COO-) akan lepas membentuk CO2 dan alkana pun dihasilkan.
Adapun reaksi yang terjadi pada dekarboksilasi Asam Karboksilat adalah:
Elektrolisis Kolbe
Elektrolisis Kolbe adalah elektrolisis dari
garam Natrium dari asam karboksilat yang akan menghasilkan gas Hidrogen di
katoda dan campuran alkana dan karbon dioksida di anoda.
Reaksi yang terjadi pada elektrolisis Kolbe adalah:
Kimia
Organik, kimia karbon, alkana, hidrokarbon, definisi alkana, pengertian
alkana, aturan tata nama alkana, aturan penamaan alkana, aturan tata
nama IUPAC alkana, aturan penamaan IUPAC alkana, aturan tata nama common
trivial alkana, aturan penamaan common trivial alkana, sifat fisika
alkana, sifat kimia alkana, sifat fisika dan kimia alkana, pembuatan
alkana
Reaksi yang terjadi pada elektrolisis Kolbe adalah:
Daftar Pustaka
Rusman; Riandari, Dwika.; 2014; Module Organic Chemistry Level XI; Bogor : Bogor High School of Chemical Analyst (SMAKBo)










waw kimia ya. keren gan pelajaran favorit ane waktu sma nih
ReplyDeleteIya gan hehehe makasih kunjungannya
Deletesangat membantu sekali terimakasih :)
ReplyDelete